Несколько научных коллективов из ИФМиБ и Института физики получили гранты РФФИ и РНФ на междисциплинарные структурные исследования биомолекул, способные в будущем открыть КФУ широкие возможности для создания принципиально новых лекарств.

В возглавляемой профессором Страсбургского университета (Франция), Почетным доктором Казанского университета Маратом Юсуповым, OpenLab «Структурная биология» изучается белоксинтезирующий аппарат (рибосома) клетки золотистого стафилококка (Staphylococcus aureus). Один из занятых в этих исследованиях молодых ученых alma mater, доцент кафедры медицинской физики Константин Усачев, параллельно исследует структуру рибосомных белков в лаборатории ЯМР Института физики. В 2015 г. его работа по структурным исследованиям цитотоксичных пептидов была отмечена дипломом I степени в конкурсе на соискание Казанской премии им. Е.К.Завойского среди молодых ученых.
Грантом РФФИ для молодых ученых в области структурных исследований биомолекул был поддержан и проект другого доцента той же кафедры, лауреата молодежной премии имени Е.К.Завойского 2014 г. Лейсан Галиуллиной, исследующий аспекты заболеваний сердечно-сосудистой системы. В лаборатории ЯМР под руководством профессора кафедры медицинской физики Владимира Клочкова исследуется также структура потенциальных лекарственных препаратов, антимикробных и цитотоксичных пептидов, пептидов участвующих в развитии болезни Альцгеймера и ВИЧ.

О своих исследованиях, удостоенных грантов, рассказывает Константин Усачев.
— Константин Сергеевич, почему Вы выбрали полем своей научной деятельности именно медицинскую физику?
— Этот выбор я сделал во время обучения в магистратуре на кафедре общей физики. Там была лаборатория ЯМР, где примерно 8 лет назад мы начали заниматься биообъектами – небольшими пептидами. Так что, это своего рода традиция, получившая сегодня активное развитие: мы переходим к изучению более сложных систем – белков и рибосом.
— А что Вас в этом привлекает как исследователя?
— В первую очередь, актуальность. Второе – перспективы использования результатов этих исследований в медицине уже в обозримом будущем. Например, часть реализуемых сейчас исследовательских проектов обладает большим потенциалом для создания принципиально новых, эффективных антибиотиков. Кроме того, если данные проекты удастся реализовать здесь, если на основе наших исследований будут созданы новые лекарства, это будет хорошим брендом КФУ. А всем нам будет очень приятно осознавать то, что мы участвовали в столь важном деле.
— Значит, Ваши исследования носят прикладной характер, направлены на практическое применение?
— Нет, это фундаментальные исследования, но они обладают потенциалом практического применения. Например, сейчас идет 1-й этап исследований, именно фундаментальный, но его результаты в перспективе могут быть успешно реализованы на практике.
— Константин Сергеевич, а насколько отдалена или, наоборот, приближена эта перспектива?
— Конкретные сроки назвать трудно, поскольку в любом исследовательском процессе непременно найдутся какие-то «подводные камни». Например, антимикробные пептиды – ученые пытаются создать лекарства на их основе примерно 15 лет. Образцы уже есть, но они до сих пор не вышли из стадии испытаний, так как обнаружились проблемы с совместимостью. Да, они эффективно уничтожают патогенные клетки, но, вместе с тем, есть вероятность их негативного воздействия на жизнедеятельность клеток человеческого организма. Ее надо ликвидировать.

Фотография стафилококка, сделанная с помощью электронного микроскопа.
— А с чем связана работа по изучению золотистого стафилококка?
— Это один из самых опасных для человека патогенов. Он вызывает множество заболеваний, начиная с легких кожных инфекций и заканчивая смертельно опасной пневмонией, менингитом, остеомиелитом и сепсисом. Кроме того, эта бактерия — одна из самых частых причин послеоперационных раневых инфекций. Ситуация осложняется тем, что ее постоянными носителями являются 25-40 % населения Земли. Бактерия сохраняется на кожных покровах и слизистых оболочках верхних дыхательных путей.
Еще одна проблема — феноменальная устойчивость золотистого стафилококка к антибиотикам. Последние исследования показали, что она обусловлена способностью бактерии образовывать в стрессовых для нее ситуациях неактивные димеры (комплексы из двух одинаковых молекул) рибосом. Структуру этих рибосом и их комплексов мы, вместе с нашими коллегами из Страсбургского университета, и изучаем. Если мы узнаем структуру рибосом, служащих молекулярными фабриками клеток, синтезирующими белки, то потом можно будет подобрать структуру новых лекарств, действующих именно против золотистого стафилококка и лишенных нежелательных побочных эффектов.
— Получается, что исследования рибосом золотистого стафилококка более актуальны, чем изучение болезни Альцгеймера, которым Вы также занимаетесь?
— Трудно сказать, что здесь более актуально. У нас, вообще, есть несколько разных проектов, связанных не только со стафилококком и болезнью Альцгеймера, но и с антимикробными пептидами, с таргетной доставкой лекарств. Но лично для меня, на 1-м месте по значимости – золотистый стафилококк. На мой взгляд, это самое актуальное и перспективное направление исследований.
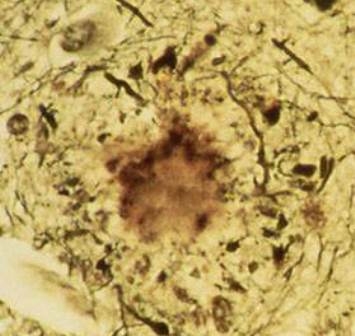
Атеросклеротическая бляшка.
Справка: Болезнь Альцгеймера, она же – сенильная деменция (приобретенное слабоумие, стойкое снижение познавательной деятельности с утратой ранее усвоенных знаний и навыков, а также с затруднением или невозможностью приобретения новых) альцгеймеровского типа – одно из самых распространенных нейродегенеративных заболеваний. Обнаруживается у людей старше 65 лет, но существует и более редкая ранняя форма. К 2050 г. общемировое число больных может достичь более 100 млн. чел.
Болезнь начинается с малозаметных симптомов и прогрессирует со временем. На ранних стадиях появляется расстройство кратковременной памяти, например, неспособность вспомнить недавно полученную информацию. Затем происходит потеря долговременной памяти, возникают нарушения речи и когнитивных функций. Больные постепенно теряют способность ориентироваться в пространстве и ухаживать за собой. Одновременно происходит потеря функций организма, которая приводит к смерти.
— А какие именно аспекты болезни Альцгеймера Вы исследуете?
— Интересен молекулярный механизм того, как пептиды, вызывающие в процессе этой болезни образование бляшек, взаимодействуют с модельными мембранами клеток. Кстати, последние исследования показали, что эти пептиды имеются и в организмах здоровых людей. До недавнего времени считалось, что они – своего рода биологический мусор, пассивный при отсутствии предпосылок к развитию болезни. Сейчас ученые выяснили, что эти пептиды могут участвовать в работе иммунной системы – уничтожать бактерии за гематоэнцефалическим барьером. Результаты наших исследований тоже с этим согласуются.
— Следовательно, эти пептиды могут стать основой для новых лекарств?
— Это не совсем так: наши исследования болезни Альцгеймера носят более фундаментальный характер – нас интересует механизм связывания этих пептидов модельными мембранами. До прикладных аспектов здесь довольно далеко, но вот сам факт того, что у них есть общие с антибиотиками свойства, которые могут использоваться в фармацевтике, проливает свет на их функции.
— С чем, с точки зрения исследователя, сложнее работать: с бактериями или с пептидами?
— Исследования золотистого стафилококка на порядок сложнее из-за его размеров. Он гораздо больше: его белки состоят из 200 и более аминокислот, а образующие бляшки пептиды – из 40. А сами рибосомы – огромные макромолекулярные комплексы, для изучения которых необходимо использовать самое современное оборудование и технологии, например, криоэлектронную микроскопию.
— А КФУ располагает такими технологиями и оборудованием?
— Да, в декабре 2014 г. в Институте физики был запущен один из наиболее мощных спектрометров высокого разрешения (700 МГц) фирмы «Bruker», оборудованный криодатчиком для исследования биомолекул. А в этом году в Междисциплинарном центре «Аналитическая микроскопия» установлен электронный микроскоп японской фирмы «Hitachi», который можно дооборудовать криоприставкой, позволяющей получать некоторые предварительные данные, которые затем можно будет использовать для исследований на более мощных микроскопах. Надеюсь, что со временем в КФУ появится свой криоэлектронный микроскоп высокого разрешения. Кроме того, для наших исследований необходимо развитие в КФУ метода кристаллографии белков.

— В исследованиях такого рода сложно что-либо прогнозировать. Но, тем не менее, существуют ли здесь какие-то предсказания открытий?
— Есть план исследований, которому мы следуем. По золотистому стафилококку: на 1-м этапе, который идет сейчас, мы должны узнать структуру его рибосом. Когда мы решим данную задачу, это будет 1-я в мире полностью расшифрованная структура рибосомы грамположительной бактерии. К этому близки наши коллеги из Страсбурга – я думаю, что уже в этом году будут публикации в «Nature» и «Science».
Далее, узнав структуру рибосомы, можно изучать сам механизм того, как димеры рибосом стафилококка предотвращают взаимодействие с антибиотиками. Научившись нарушать этот механизм, можно заставить рибосомы «открываться» для антибиотиков, и таким образом создать лекарство от стафилококка. Все это, от первой до последней стадии, планируется сделать в КФУ объединенными усилиями наших биологов, физиков, химиков и фармацевтов.
Отрадно, что проекты в новой для КФУ научной области — структурной биологии — получают поддержку, как со стороны внешних фондов, так и со стороны руководства КФУ, тем более, что сейчас в университете закладываются предпосылки для прорыва в лидеры сразу по нескольким областям знания. А мы, в свою очередь, постараемся, чтобы Казанский университет стал еще более известным в мире.
— Константин Сергеевич, благодарю Вас за столь обстоятельный рассказ. Надеюсь, что со временем исследования наших ученых помогут человечеству покончить с целым рядом опасных заболеваний.
 Вход
Вход
 Газета «Казанский университет»
Газета «Казанский университет»